不同类型的 COVID-19 疫苗:作用原理
了解不同疫苗技术如何与免疫系统协同工作以提供保护。
来自妙佑医疗国际员工
接种 COVID-19 疫苗可降低感染后发病、发展为重症或导致死亡的风险。但不同类型的 COVID-19 疫苗是如何发挥作用的呢?
每种 COVID-19 疫苗都可使免疫系统产生称为抗体的蛋白。这些蛋白可抵抗 COVID-19 病毒感染。COVID-19 疫苗利用了 COVID-19 病毒表面称为 S 蛋白的无害版刺突结构。
有几种主要类型的 COVID-19 疫苗。
信使 RNA(mRNA)疫苗
mRNA 疫苗
mRNA 疫苗
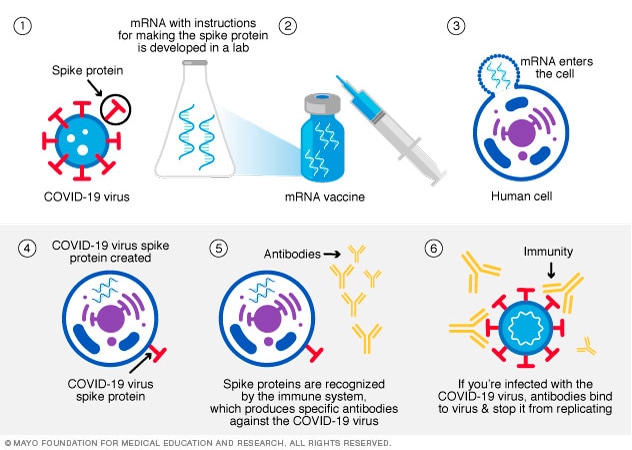
mRNA 疫苗指导细胞如何制造在 COVID-19 病毒表面发现的 S 蛋白。
注射疫苗把 mRNA 送入肌肉。肌肉细胞可能摄取 mRNA 并合成 S 蛋白。另外,免疫细胞也可能摄取 mRNA。无论是 mRNA 还是 S 蛋白,都会向身体发出病毒风险警报。接着,身体开始产生免疫反应,防止您因感染而生病。
载体疫苗
病毒载体疫苗
病毒载体疫苗
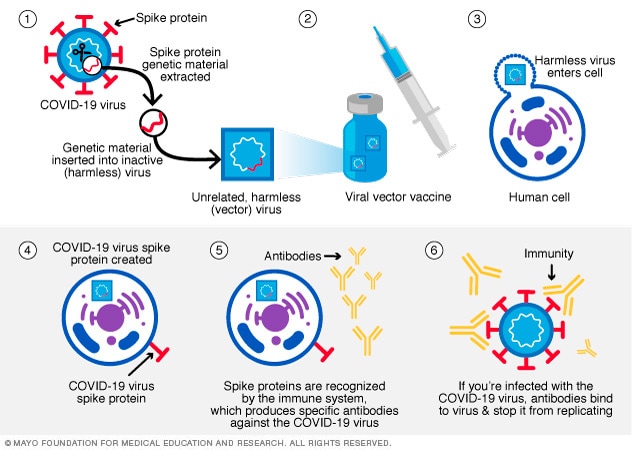
这类疫苗把病毒中导致 COVID-19 的物质置入经过改造的另一种病毒。这种不同的病毒称为病毒载体。病毒载体给细胞下指令,复制 COVID-19 病毒的 S 蛋白。
细胞在表面显示 S 蛋白后,免疫系统会做出反应,产生抗体和防御性白细胞。如果在这之后感染了导致 COVID-19 的病毒,抗体将帮助清除病毒。
病毒载体疫苗不会导致感染 COVID-19 病毒或病毒载体病毒。强生公司的 COVID-19 疫苗是载体疫苗,在美国已经不再使用。
蛋白亚单位疫苗
蛋白质亚单位疫苗
蛋白质亚单位疫苗
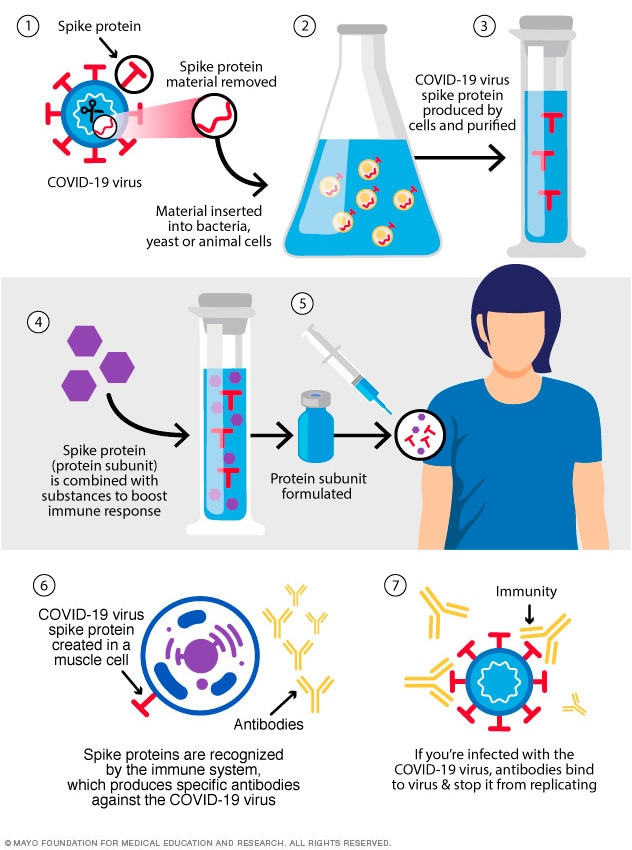
亚单位疫苗仅包括最能刺激免疫系统的病毒部分。这类 COVID-19 疫苗含有无害的 S 蛋白。免疫系统识别出 S 蛋白后,会产生抗体和防御性白细胞。如果此后感染了 COVID-19 病毒,抗体将帮助清除病毒。
诺瓦瓦克斯 COVID-19 疫苗是一种蛋白亚单位疫苗。
COVID-19 疫苗
美国可以使用的 2025 - 2026 年 COVID-19 疫苗包括莫德纳、辉瑞-生物科技和诺瓦瓦克斯。这些疫苗均已获得批准,可以用于 65 岁及以上者。每款疫苗也已获得批准,可以用于因健康状况而存在 COVID-19 重症风险的年龄较轻者。
莫德纳 COVID-19 疫苗 2025-2026 年配方。
- Spikevax。 该疫苗已获得批准,可以用于 6 月龄至 64 岁且存在 COVID-19 重症风险者以及所有 65 岁及以上者。
- Mnexspike。 该疫苗已获得批准,可以用于 12 至 64 岁且存在 COVID-19 重症风险者以及所有 65 岁及以上者。
辉瑞-生物科技 COVID-19 疫苗 2025-2026 年配方。
- Comirnaty。 该疫苗已获得批准,可以用于 5 至 64 岁且存在 COVID-19 重症风险者以及所有 65 岁及以上者。
诺瓦瓦克斯 COVID-19 疫苗 2025-2026 年配方。
- Nuvaxovid。 该疫苗已获得批准,可以用于 12 至 64 岁且存在 COVID-19 重症风险者以及所有 65 岁及以上者。
辉瑞-生物科技和莫德纳的 2025-2026 年 COVID-19 疫苗均以预防 LP.8.1 病毒株为重点。诺瓦瓦克斯 COVID-19 疫苗有助于建立对 JN.1 病毒株的保护力。
谁应该接种 COVID-19 疫苗?
接种 COVID-19 疫苗可以预防重症和防止因 COVID-19 需要住院治疗或是因 COVID-19 死亡。根据最新要求接种疫苗对于高风险人群最为重要。其中包括 65 岁以上成人、免疫系统功能低下者、怀孕者,以及患有心脏病、肺病或肥胖症等慢性医疗状况者。
传染病暴发史和疫苗发展时间线
了解重大疾病暴发、流行病和大流行病的历史,以及疫苗和研究对许多传染病的影响。
详细了解传染病暴发史和疫苗发展时间线。
Dec. 31, 2025
- COVID-19 vaccine basics. Centers for Disease Control and Prevention. https://www.cdc.gov/covid/vaccines/how-they-work.html. Accessed Oct. 11, 2024.
- The different types of COVID-19 vaccines. World Health Organization. https://www.who.int/news-room/feature-stories/detail/the-race-for-a-covid-19-vaccine-explained. Accessed Feb. 3, 2021.
- Edwards KM, et al. COVID-19: Vaccines. https://www.uptodate.com/contents/search. Accessed Oct. 11, 2024.
- Amanat F, et al. SARS-CoV-2 vaccines: Status report. Immunity. 2020; doi:10.1016/j.immuni.2020.03.007.
- Staying up to date with COVID-19 vaccines. Centers for Disease Control and Prevention. https://www.cdc.gov/covid/vaccines/stay-up-to-date.html. Accessed Oct. 11, 2024.
- Vaccine types. U.S. Department of Health and Human Services. https://www.hhs.gov/immunization/basics/types/index.html. Accessed Feb. 2, 2021.
- Vaccine types. National Institute of Allergy and Infectious Diseases. https://www.niaid.nih.gov/research/vaccine-types. Accessed Feb. 2, 2021.
- Real-time learning network vaccines FAQ. Infectious Diseases Society of America. https://www.idsociety.org. Accessed Oct. 11, 2024.
- Vaxzevria (previously COVID-19 Vaccine AstraZeneca). European Medicines Agency. https://www.ema.europa.eu/en/medicines/human/EPAR/vaxzevria. Accessed Oct. 11, 2024.
- Pardi N, et al. mRNA vaccines for infectious diseases — Advances, challenges and opportunities. Nature Reviews Drug Discovery. 2024; doi:10.1038/s41573-024-01042-y.
- Spikevax (approval letter). Biologic License Application 125752. U.S. Food and Drug Administration. https://www.fda.gov/vaccines-blood-biologics/spikevax. Accessed Sept. 25, 2025.
- Mnexspike (approval letter). Biologic License Application 125835 U.S. Food and Drug Administration. https://www.fda.gov/vaccines-blood-biologics/mnexspike. Accessed Sept. 25, 2025.
- Comirnaty (approval letter). Biologic License Application 125742. U.S. Food and Drug Administration. https://www.fda.gov/vaccines-blood-biologics/comirnaty. Accessed Sept. 25, 2025.
- Nuvaxovid (approval letter). Biologic License Application 125817. U.S. Food and Drug Administration. https://www.fda.gov/vaccines-blood-biologics/vaccines/nuvaxovid. Accessed Sept. 25, 2025.
- Medical review (expert opinion). Mayo Clinic. Sept. 25, 2025.