التشخيص
لتشخيص الورم الحبلي، قد يُجري اختصاصي الرعاية الصحية فحصًا بدنيًا ويطرح أسئلة عن سيرتك المرضية. قد تشمل الفحوصات والإجراءات الطبية الأخرى إجراءَ اختبارات تصويرية وأخذ عينة من الأنسجة لفحصها في المختبر.
الاختبارات التصويرية، مثل التصوير المقطعي المحوسب أو التصوير بالرنين المغناطيسي
تلتقط الاختبارات التصويرية صورًا للجسم. وتساعد هذه الصور في تحديد حجم الورم وموضعه بدقة. التصوير المقطعي المحوسب هو الفحص الأفضل لمعرفة التغيرات في العظام. التصوير بالرنين المغناطيسي هو الفحص الأفضل للكشف عن الأورام والأنسجة المحيطة بها.
- التصوير المقطعي المحوسب. يتميز التصوير المقطعي المحوسب بدقته في الكشف عن التغيرات التي تحدث في العظام، مثل المناطق المصابة بالتنخر أو الهشاشة. تظهر الأورام الحبلية عادة في التصوير المقطعي المحوسب على شكل بقع فاتحة أو داكنة، مع تلف عظام حولها. قد يُظهر التصوير المقطعي المحوسب أيضًا ما إذا كان قد انتشر الورم أم لا، كأن يكون قد انتشر قريبًا من عظام الجمجمة والرقبة. تُستخدم في بعض الأحيان صبغة خاصة تسمى وسط تبايني لإجراء التصوير المقطعي المحوسب. تبدو الصبغة ساطعة في الصور، ما يساعد في وضوح بعض المناطق الجاري تصويرها بشكل أفضل.
- التصوير بالرنين المغناطيسي. التصوير بالرنين المغناطيسي هو الفحص الأفضل في الكشف عن الأورام والأوعية الدموية المحيطة بها. يمكن للتصوير بالرنين المغناطيسي أن يُظهر ما إذا كان الورم يحتوي على أجزاء مختلفة، ومدى تأثيره في الأنسجة المحيطة بالعمود الفقري. عادة ما تظهر الأورام الحبلية على شكل بقع فاتحة مع وجود مناطق داكنة داخلها.
الخزعة
الخزعة إجراءٌ تُسحب فيه عينة من الأنسجة لفحصها في المختبر. الخزعة ضرورية للتأكد من أن ما ظهر في الفحوصات التصويرية هو الورم الحبلي. وذلك لأن الورم الحبلي يظهر في الفحوصات التصويرية مشابهًا لحالات أخرى تتطلب علاجات مختلفة. بالنسبة إلى الورم الحبلي، يمكن جمع عينة من الأنسجة بالطرق التالية:
- إدخال إبرة عبر الجلد. يُدخِل اختصاصي الرعاية الصحية إبرة رفيعة عبر الجلد ويوجهها إلى داخل السرطان أثناء إجراء الخزعة بالإبرة. يستخدم اختصاصي الرعاية الصحية الإبرة لجمع عينات صغيرة من الأنسجة. قد لا يمكن إجراء الخزعة قبل الجراحة بالنسبة إلى بعض الأورام الحبلية، كالتي تظهر في قاعدة الجمجمة.
- أخذ عينة أثناء الجراحة. أثناء إجراء الخزعة الجراحية، يُحدث الجرَّاح قطعًا في الجلد، يُسمى شقًا، للوصول إلى الورم. ثم يستأصل جزءًا من الورم لفحصه.
يتطلب تحديد كيفية إجراء الخزعة تخطيطًا دقيقًا من فريق الرعاية الصحية. يجب أن يجري فريق الرعاية الخزعة بطريقة تتيح استئصال الورم في الجراحة القادمة. لهذا يُستحسن الحصول على الرعاية في مركز طبي يستقبل كثيرًا من المصابين بالورم الحبلي.
وللتأكد من الإصابة بالورم الحبلي، يبحث فريق الرعاية الصحية عن المؤشرات المرضية للورم الحبلي. ويمكن أن تشمل ما يلي:
- وجود خلايا مفوقعة؛ وهي خلايا تبدو كأنها تحتوي على فقاعات من الداخل.
- ظهور بروتين براتشيوري؛ وهو بروتين خاص شائع في خلايا الورم الحبلي.
- وجود بروتينات أخرى، مثل S100، وفيمنتين، والكيراتينات الخلوية الشاملة.
اختبار الجينات
اختبارات الجينات ليست إجراءً روتينيًا في تشخيص الورم الحبلي. لكن في بعض الأحيان يوصَى بالخضوع لاختبارات الجينات للعائلات التي لديها سيرة مَرضية ترتبط بالإصابة بالورم الحبلي، أو للأطفال واليافعين المصابين به.
العلاج
يتحدد علاج الورم الحبلي بناءً على حجم الورم وموقعه، فضلاً عما إذا كان قد انتشر إلى الأعصاب أو الأنسجة الأخرى.
- غالبًا ما تكون الجراحة الخطوة الأولى وإحدى طرق العلاج المهمة للورم الحبلي. يوفر استئصال الورم بالكامل أفضل فرصة للعلاج.
- يُستخدم العلاج الإشعاعي عادة بعد الجراحة، لقتل أي خلايا سرطانية قد تظل متبقية. يُستخدم العلاج الإشعاعي في بعض الأحيان قبل الجراحة لجعل السرطان أصغر وتسهيل استئصاله. يمكن أحيانًا استخدام العلاج الإشعاعي وحده، إذا تعذر استئصال الورم جراحيًا.
- يمكن استخدام أدوية العلاج الاستهدافي لعلاج النقائل وهي حالة ينتشر فيها السرطان في الجسم، أو لعلاج الانتكاس وهو حالة يعاود فيها السرطان الظهور بعد العلاج الأولي.
في بعض الحالات، يمكن علاج الورم الحبلي. لكن قد يكون ذلك صعبًا في حالات أخرى. إذ من الصعب استئصال الأورام الحبلية بالكامل لأنها تنمو بالقرب من الدماغ والعمود الفقري. وتقاوم العلاج الإشعاعي والكيميائي التقليدي. غالبًا ما تعاود الأورام الحبلية الظهور. ويُسمى ذلك الانتكاس. عندما يحدث ذلك، يمكن أن يساعد العلاج في التحكم في السرطان بمرور الوقت أو إدارته وليس علاجه.
الجراحة
جراحة قاعدة الجمجمة بالتنظير الداخلي
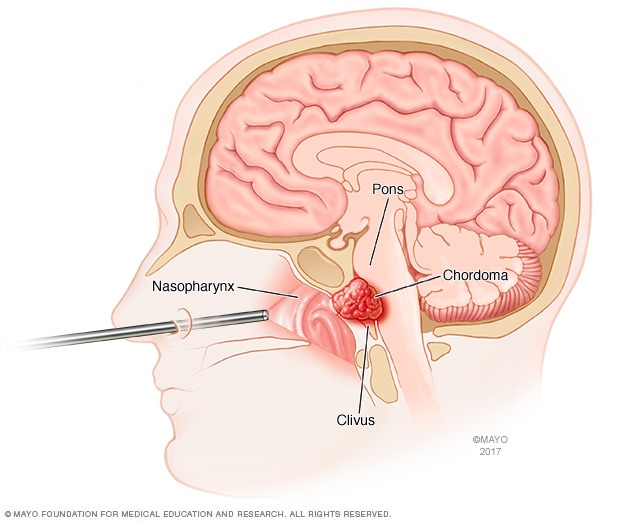
جراحة قاعدة الجمجمة بالتنظير الداخلي
تَستخدم جراحة قاعدة الجمجمة بالمنظار أنبوبًا طويلاً ورفيعًا يُسمى المنظار الداخلي للوصول إلى قاعدة الجمجمة. يُدخِل الجرّاح المنظار الداخلي من خلال الأنف. ثم يُدخِل الأدوات من خلال المنظار الداخلي لإجراء الجراحة. يوضح هذا الرسم التوضيحي منظارًا داخليًا يُدخَل من خلال الأنف لعلاج الورم الحبلي، وهو نوع من سرطان العظام يحدث غالبًا في قاعدة الجمجمة.
في جراحة الورم الحبلي، يركز الجرَّاحون على استئصال أكبر قدر ممكن من الورم قطعة واحدة. يُسمى الإجراء استئصالاً ككتلة عند إجرائه في العمود الفقري المتحرك أو عظم العجز. وعند استئصال الورم الحبلي بالكامل قطعة واحدة، يقلل الإجراء احتمالية انتشار الخلايا السرطانية وعودة السرطان.
لكن يمكن أن يصعب استئصال الورم الحبلي بالكامل. يرجع ذلك إلى أن الأورام الحبلية تنمو حول بِنى مهمة في الجسم، بما فيها الدماغ والحبل النخاعي والأعصاب والأوعية الدموية. يحاول الجرَّاحون استئصال الورم من دون إتلاف البِنى السليمة. ويصعب أيضًا الوصول بأمان إلى أجزاء من قاعدة الجمجمة.
يحاول الجرَّاحون استئصال أكبر قدر ممكن من الورم الحبلي إذا تعذَّر استئصاله بالكامل.
قد يختلف نوع الجراحة حسب مكان الورم على النحو التالي:
- جراحة استئصال الورم الحبلي في قاع الجمجمة. في بعض الحالات، يمكن أن يصل الجرَّاحون إلى الورم الحبلي في قاعدة الجمجمة من خلال الأنف. ويُسمى هذا النوع من الجراحة جراحة قاعدة الجمجمة بالتنظير الداخلي. ويُستخدم فيه أنبوب طويل ورفيع، يُسمى منظارًا داخليًّا. يُدخِل الأطباء هذا المنظار عبر الأنف للوصول إلى السرطان. ويمكن تمرير أدوات خاصة عبر المنظار الداخلي لاستئصال السرطان. يلزم في بعض الحالات إجراء جراحة مفتوحة تقليدية. أثناء الجراحة المفتوحة، يستخدم الجرَّاح أدوات جراحية يدخلها من خلال شق كبير في مؤخرة الرأس أو العنق. وقد تُستخدَم أيضًا نُهُج أخرى.
- جراحة استئصال الورم الحبلي في العمود الفقري المتحرك وعظم العجز. الهدف من جراحة استئصال الورم الحبلي في مناطق العمود الفقري الموجودة أسفل قاعدة الجمجمة هو إزالة أكبر قدر ممكن من الورم. يمكن أيضًا إزالة العظام والأنسجة الأخرى المحيطة. إذا كان الورم في عظم العجز الموجود في أسفل العمود الفقري، فقد يمكن إزالة هذا العظم بالكامل. ويُسمى هذا الإجراء استئصال العجز. يمكن إجراء هذه الجراحة بإحداث شق في البطن أو الظهر.
ونادرًا ما ينصح الجرَّاحون بإجراء جراحة أخرى لتدعيم المنطقة التي أصابها السرطان.
تشمل المضاعفات الناتجة عن جراحة استئصال الورم الحبلي مخاطر أي جراحة أخرى، مثل العدوى والجلطات الدموية والنزيف. يمكن أن تحدث مضاعفات أيضًا في حال تلف الأعصاب أثناء الجراحة. تشمل المضاعفات المحتملة:
- ازدواج الرؤية.
- تغيرات في عادات التبول أو التبرز.
- فقدان الوظائف الجنسية.
- الخدر أو فقدان الإحساس.
- صعوبة المشي أو الجلوس.
- تسرُّب السائل الدماغي النخاعي، وهو سائل يحيط بالدماغ والحبل النخاعي.
الإشعاع
يستهدف العلاج الإشعاعي السرطان باستخدام أشعة عالية الطاقة. يمكن توليد الطاقة من الأشعة السينية أو الفوتونات أو البروتونات أو غيرها من المصادر.
أثناء العلاج الإشعاعي، يُطلب منك الاستلقاء على طاولة بينما يتحرك الجهاز من حولك. يوجِّه هذا الجهاز الإشعاع إلى نقاط محددة بدقة في الجسم.
في الماضي، قاومت الأورام الحبلية الإشعاع القياسي الذي لزم إعطاؤه بجرعة منخفضة بما يكفي لتجنُّب إتلاف أي جزء قريب من الحبل النخاعي أو أنسجة الدماغ. قد تساعد العلاجات الإشعاعية الأحدث عن طريق توصيل جرعة أعلى من الإشعاع إلى الورم مباشرة وبدقة أكبر، مع حماية الدماغ والحبل النخاعي والأعصاب المحيطة. تشمل أمثلة خيارات الإشعاع ما يلي:
يختلف نوع العلاج الإشعاعي المستخدم باختلاف مكان السرطان والخيارات المتاحة لدى المركز الجراحي.
قد تشمل الآثار الجانبية للعلاج الإشعاعي ما يلي:
- التعب.
- تورم الجلد أو تهيُّجه أو حدوث تغيرات أخرى به.
- الصداع.
- قصور النخامية؛ أي حدوث تغيرات هرمونية.
- تغيرات أو تلف في الدماغ.
- تغيرات في السمع والرؤية.
- صعوبة البلع.
ثمة أيضًا خطر طفيف باحتمالية الإصابة بنوع مختلف من السرطان لاحقًا بسبب العلاج الإشعاعي، يُسمى السرطان الثانوي.
أدوية العلاج الاستهدافي
لا يقل حجم الورم الحبلي عادة باستخدام العلاج الكيميائي القياسي. ولكن يستخدم علاج السرطان الاستهدافي أدوية تهاجم مواد كيميائية محددة في الخلايا السرطانية. يمكن أن تقضي هذه العلاجات الاستهدافية على الخلايا السرطانية عن طريق حجب هذه المواد الكيميائية.
يُستخدم العلاج الاستهدافي أحيانًا كجزء من التجارب السريرية. أو يُستخدم بطريقة مختلفة عن استخدامه الأصلي لعلاج الورم الحبلي النقيلي، وهو ورم حبلي ينتشر إلى مناطق أخرى في الجسم. يعني استخدام الدواء بطريقة مختلفة عن استخدامه الأصلي أن إدارة الغذاء والدواء الأمريكية قد اعتمدت هذا الدواء لعلاج حالة مختلفة. قد يُستخدَم العلاج الاستهدافي أيضًا لعلاج الورم الحبلي الذي يعاود الظهور بعد العلاج.
تشمل بعض الأمثلة على العلاج الاستهدافي الذي يمكن استخدامه أولاً لعلاج الورم الحبلي ما يلي:
- إيماتينيب.
- داساتينيب.
- سونيتينيب.
وقد تُستخدَم أدوية أخرى في بعض الأحيان، بما في ذلك:
- إيماتينيب إلى جانب دواء العلاج الكيميائي أو سيروليمس.
- إرلوتينيب.
- لاباتينيب.
- سورافينيب.
قد تشمل الآثار الجانبية للعلاج الاستهدافي ما يلي:
- التعب.
- اضطراب المعدة.
- الطفح الجلدي.
- الإسهال.
- التورم.
- تغيرات في الغدة الدرقية والكلى.
العلاجات الخاضعة للدراسة
يواصل العلماء إجراء الأبحاث عن علاجات جديدة محتملة للورم الحبلي. يشمل بعضها ما يلي:
- مثبطات نقاط التفتيش. إنها نوع من الأدوية يساعد الجهاز المناعي في العثور على الخلايا السرطانية ومهاجمتها.
- العلاجات التي تستهدف بروتين براتشيوري. غالبًا ما تنتج الأورام الحبلية بروتين براتشيوري. لذا، تخضع اللقاحات والأدوية الجديدة التي تستهدف بروتين براتشيوري للاختبار.
للمزيد من المعلومات
التأقلم والدعم
مع مرور الوقت، ستكتشف ما يعينك على التكيف مع القلق والغموض اللذين يصاحبان تشخيص السرطان. وحتى ذلك الحين، قد يكون من المفيد أن:
احرص على اكتساب المعرفة الكافية حول حالات الورم الحبلي لتتمكن من اتخاذ قرارات مستنيرة بشأن الرعاية التي تحتاج إليها
استشر فريق الرعاية الصحية عن حالة السرطان لديك، بما في ذلك نتائج الاختبارات وخيارات العلاج، وأيضًا مآل المرض إذا رغبت في ذلك. كلما تعمَّقت معرفتك بالورم الحبلي، زادت ثقتك في اتخاذ قرارات العلاج.
إضافة إلى ذلك، يمكن أن تساعد الأجهزة والمعدات في مواجهة بعض المخاوف المتعلقة بالحركة. وتتوفر بعض العلاجات إذا كنت تشعر بألم السرطان. قد تعتمد الخيارات على سبب ألم السرطان وشدة الألم الذي تشعر به.
التقرب إلى الأصدقاء أو العائلة أو المجتمع
يمكن أن يساعد الأصدقاء أو العائلة أو الموارد المجتمعية في توفير الدعم العملي الذي قد تحتاج إليه. على سبيل المثال، قد يشمل ذلك العناية بمنزلك عندما تكون في المستشفى.
البحث عن شخص ما للتحدث إليه
ابحث عن شخص ينصت إليك باهتمام بينما تشارك معه آمالك ومخاوفك. وقد يكون هذا الشخص صديقًا أو فردًا من العائلة. وقد تفيدك أيضًا أمور أخرى مثل الحصول على اهتمام ودعم من أحد الاستشاريين أو من اختصاصيي الطب الاجتماعي أو رجال الدين أو إحدى مجموعات دعم مرضى السرطان.
اسأل فريق الرعاية الصحية عن مجموعات الدعم الموجودة في منطقتك. تشمل مصادر المعلومات الأخرى المعهد الوطني للسرطان، والجمعية الأمريكية للسرطان، ومؤسسة Chordoma، ومجموعة الدعم عبر الإنترنت من خلال منصة مايو كلينك Connect قسم ساركوما. تقدم مؤسسة Chordoma أيضًا دليل الاتصال باختصاصيي علاج الورم الحبلي.
الاستعداد لموعدك
إذا لاحظت ظهور أي أعراض تُثير قلقك، فلا تتردد في حجز موعد طبي مع طبيب أو اختصاصي رعاية صحية. إذا اشتبه اختصاصي الرعاية الصحية في إصابة المريض بالورم الحبلي، فقد يُحال إلى اختصاصي في هذا المجال.
نظرًا إلى قِصَر مدة المواعيد الطبية، فمن المفيد التحضير سابقًا لها. إليك بعض المعلومات التي ستساعدك على الاستعداد.
ما يمكنك فعله
- كن على علم بأي تجهيزات لازمة قبل الحضور. عند حجز الموعد الطبي، استفسر عن أي تجهيزات ضرورية قبل الحضور، مثل الالتزام بنظام غذائي محدد.
- دَوِّن الأعراض التي تلاحظها، حتى لو بدت غير مرتبطة بالسبب الذي دفعك إلى حجز الموعد الطبي.
- دوِّن المعلومات الشخصية المهمة، مثل التوترات النفسية الشديدة أو التغيرات التي طرأت مؤخرًا على حياتك.
- حَضِّر قائمة بكل الأدوية والفيتامينات والمكمِّلات الغذائية التي تستخدمها، مع ذكر الجرعات.
- اصطحب معك أحد أفراد العائلة أو صديقًا. قد يصعب تذكُّر كل المعلومات التي تُطرَح أثناء الموعد الطبي. وقد يتذكر مَن يرافقك معلومةً قد فاتتك أو نسيتها.
- دوِّن الأسئلة التي تود طرحها على فريق الرعاية الصحية.
وقتك مع فريق الرعاية الصحية محدود، لذلك سيساعدك إعداد قائمة بالأسئلة على تحقيق أقصى استفادة من وقتكما معًا. رتِّب أسئلتك من الأهم إلى الأقل أهمية، تحسّبًا لنفاد الوقت. من الأسئلة الأساسية التي يمكن طرحها في حالة الورم الحبلي:
- هل أنا مصاب بورم حبلي؟
- ما مرحلة الورم الحبلي لديَّ؟
- هل انتشر الورم الحبلي إلى أجزاء أخرى من جسمي؟
- هل هناك حاجة إلى اختبارات إضافية؟
- ما خيارات العلاج المتاحة؟
- إلى أي مدى يمكن أن تسهم كل خطة علاجية في تحسين فرص شفائي أو إطالة عمري؟
- ما الآثار الجانبية المتوقعة لكل خيار علاجي؟
- كيف سيؤثر كل علاج في حياتي اليومية؟
- هل هناك خيار علاجي تعتقد أنه الأفضل؟
- لو كان أحد أفراد عائلتك أو أصدقائك في وضعي، ما العلاج الذي كنت ستوصيه به؟
- هل يجب علي مراجعة اختصاصي؟
- هل توجد كتيّبات أو مواد مطبوعة يمكنني أخذها معي؟ ما المواقع الإلكترونية التي توصي بتصفحها؟
- ما العوامل التي تستدعي تحديد موعد زيارة تفقدية لحالتي؟
لا تتردد في طرح أي أسئلة أخرى.
ما يمكنك توقعه من الطبيب
كن مستعدًا للإجابة عن أسئلة مثل:
- متى بدأ ظهور الأعراض؟
- هل الأعراض التي تشعر بها مستمرة أم عرضية؟
- ما مدى شدة الأعراض؟
- ما الذي يبدو أنه يحسن أعراضك، إن وُجد؟
- ما العوامل التي تعتقد أنها تزيد حدة الأعراض، إن وُجدت؟